Associação Portuguesa de Investigação em Cancro
Um possível novo mecanismo que controla o movimento do STAT3 nas células cancerígenas
Um possível novo mecanismo que controla o movimento do STAT3 nas células cancerígenas
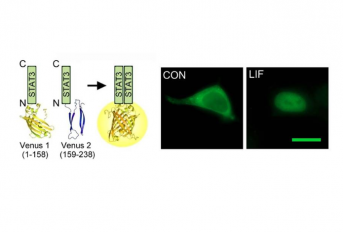
STAT3 é um fator de transcrição ativado constitutivamente em 70% dos tumores sólidos, onde está relacionado com a proliferação e a sobrevivência das células cancerígenas e com as respostas inflamatórias associadas ao cancro. Por outro lado, mutações inativadoras do STAT3 causam a síndrome da hiper IgE e tornam os pacientes mais propensos a desenvolver tumores. Para que o STAT3 ative a expressão de genes relacionados com o cancro e a inflamação, ele deve formar pares com outras moléculas de STAT3 e passar do citoplasma para o núcleo ou as mitocôndrias. Os autores deste artigo desenvolveram um sistema para visualizar esses fenómenos nas células vivas. Combinamos moléculas de STAT3 com diferentes modificações e observamos que elas são significativamente mais propensas a mudar de localização dentro das células cancerígenas do que os pares STAT3 onde as duas moléculas são igualmente modificadas. Alguns dos destes pares “assimétricos” também alteraram a proliferação de células cancerígenas, enquanto os que estavam igualmente modificados não. Essas observações desafiam o consenso implícito atual de que as duas moléculas STAT3 dentro de um par são praticamente idênticas em todos os aspectos. Do nosso ponto de vista, um par STAT3 poderia funcionar com apenas uma das moléculas ativas, o que poderia ter implicações terapêuticas para o cancro e outras patologias relacionadas com o STAT3. Embora o nosso sistema tenha várias limitações técnicas e, por isso, devemos ser cautelosos na interpretação dos resultados, as nossas observações também podem ser estendidas a outros processos de sinalização, porque a formação de dímeros e as modificações das proteínas como as que descrevemos aqui são muito comuns na natureza.
Autores e Afiliações:
Ricardo Letra‐Vilela, 1 , 2 Beatriz Cardoso, 1 Catarina Silva‐Almeida, 1 Ana Maia Rocha, 1 Fernanda Murtinheira, 1 , 2 Joana Branco‐Santos, 1 Carmen Rodriguez, 3 Vanesa Martin, 3 Mariana Santa‐Marta, 1 and Federico Herrera 1 , 2
1 Cell Structure and Dynamics Laboratory, Instituto de Tecnologia Quimica e Biologica (ITQB‐NOVA), Universidade Nova de Lisboa, Oeiras Portugal,
2 Cell Structure and Dynamics Laboratory, Faculdade de Ciências, Universidade de Lisboa, Lisbon Portugal,
3 Instituto Universitario de Oncología del Principado de Asturias (IUOPA) and Departamento de Morfología y Biología Celular, Facultad de Medicina, University of Oviedo, Oviedo Spain,
Abstract:
Signal transducer and activator of transcription 3 (STAT3) is a ubiquitous and pleiotropic transcription factor that plays essential roles in normal development, immunity, response to tissue damage and cancer. We have developed a Venus‐STAT3 bimolecular fluorescence complementation assay that allows the visualization and study of STAT3 dimerization and protein‐protein interactions in living cells. Inactivating mutations on residues susceptible to post‐translational modifications (PTMs) (K49R, K140R, K685R, Y705F and S727A) changed significantly the intracellular distribution of unstimulated STAT3 dimers when the dimers were formed by STAT3 molecules that carried different mutations (ie they were “asymmetric”). Some of these asymmetric dimers changed the proliferation rate of HeLa cells. Our results indicate that asymmetric PTMs on STAT3 dimers could constitute a new level of regulation of STAT3 signaling. We put forward these observations as a working hypothesis, since confirming the existence of asymmetric STAT3 homodimers in nature is extremely difficult, and our own experimental setup has technical limitations that we discuss. However, if our hypothesis is confirmed, its conceptual implications go far beyond STAT3, and could advance our understanding and control of signaling pathways.
Revista: FASEB Bioadvances
Link: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7003655/




